已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是
A.X的能量一定低于M的能量,Y的能量一定低于N的能量
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
知识点:化学反应与能量的变化
D
略
100mL 0.10mol/L的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入100mL溶有0.01mol CuSO4·5H2O的溶液,充分反应。下列说法中正确的是
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.最终得到的溶液中,Cl-的物质的量为0.02mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.01mol/L
知识点:离子反应
B
略
如图所示是298 K时N2与H2反应过程中 ,能量变化的曲线图.下列叙述正确的是

A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 ΔH=-92 kJ/mol
2NH3 ΔH=-92 kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反
应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
知识点:化学反应与能量的变化
D
略
已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子的总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
知识点:离子浓度比较
C
略
有关常温下pH均为3的醋酸和硫酸的说法正确的是
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
知识点:弱电解质的电离
A
略
下列各选项中所述的两个量,前者一定大于后者的是
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数
B.pH=1的CH3COOH溶液和盐酸的物质的量浓度
C.pH=12的氨水和NaOH溶液的导电能力
D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积
知识点:水的电离和溶液的酸碱性
B
略
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混
合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
A.溶液中由水电离产生的H+浓度为1×10-7 mol/L
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
知识点:水的电离和溶液的酸碱性
B
略
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是
编号
HX
YOH
溶液的体积关系
①
强酸
强碱
V(HX)=V(YOH)
②
强酸
强碱
V(HX)<V(YOH)
③
强酸
弱碱
V(HX)=V(YOH)
④
弱酸
强碱
V(HX)=V(YOH)
A.①③ B.②③ C.①④ D.②④
知识点:水的电离和溶液的酸碱性
D
略
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B. 将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为
1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂
知识点:溶解平衡
D
略
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)=c(H+)+c(NH4+)
知识点:离子浓度比较
B
略
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是
A. 反应开始到10s,用Z表示的反应速率为
0.158mol/(L·s)
B. 反应开始时10s,X的物质的量浓度减少
了0.79mol/L
C.反应开始时10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
知识点:化学反应速率和化学平衡的计算
C
略
对达到平衡状态的可逆反应X+Y![]() Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
知识点:化学平衡状态及移动
A
略
在一个V升的密闭容器中放入2L
A气体和1L
B气体,在一定条件下发生反应:3A(g)+
B(g)![]() nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
A、1 B、2 C、3 D、4
知识点:化学反应速率和化学平衡的计算
A
略
在一定温度下,可逆反应A(g) + 3B(g) ![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A、A的生成速率与C的分解速率相等;
B、单位时间内生成n molA,同时生成3n molB;
C、A、B、C的浓度不再变化;
D、A、B、C的浓度之比为1:3:2
知识点:化学平衡状态及移动
C
略
现有A、B、C、D四种溶液,它们分别是AlCl3溶液、盐酸、氨水、Na2SO4溶液中的一种,已知A、B两溶液中的水的电离程度相同,A、C两溶液的pH相同。则下列说法中正确的是
A.A为AlCl3溶液,C为盐酸
B.向C中加入足量B,反应的离子方程式为Al3++3OH-=Al(OH)3↓
C.A、B等体积混合后,溶液中各离子浓度由大到小的顺序为
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.溶液中的水的电离程度:A=B<C<D
知识点:电解质溶液
C
略
已知AgCl (s) ![]() Ag+ + Cl-,平衡时,c(Ag+ )·c(Cl-)
=Ksp ,过量氯化银分别投入①100 mL水 ②24
mL 0.1 mol·L-1NaCl ③10
mL 0.1 mol·L-1MgCl2 ④30
mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+ )大小顺序为
Ag+ + Cl-,平衡时,c(Ag+ )·c(Cl-)
=Ksp ,过量氯化银分别投入①100 mL水 ②24
mL 0.1 mol·L-1NaCl ③10
mL 0.1 mol·L-1MgCl2 ④30
mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+ )大小顺序为
A、③①②④ B、④①②③ C、①②③④ D、④③②①
知识点:溶解平衡
B
略
已知100℃ KW=10-12若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为 (写出计算过程)。
知识点:溶液PH值的计算
2:9
略
已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题。
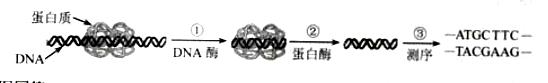
(1) a点溶液中c(H+)为 mol·L-1;
(2) b点溶液中离子浓度大小顺序为
或 。C点溶液中离子浓度大小顺序为 。
(3) a、b、c三点中水的电离程度最大的是 。
知识点:离子浓度比较
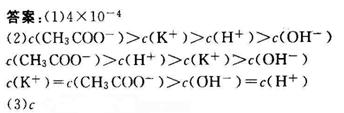
略
按要求写热化学方程式:
(1) 已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
___________________________________________________________________.
(2) 25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程
式__________________________________________________.
(3) 已知下列热化学方程式:
① CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
② C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③ H2(g)+O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_________.
知识点:反应热的计算
(1) H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
(2)C4H10(g)+O2(g)===4CO2(g)+5H2O(l) ΔH=-16Q kJ/mol
(3)2C(s)+2H2(g)+O2(g)===CH3COOH(l) ΔH=-488.3 kJ/mol
略
某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1) 若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2) 若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3) 若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
知识点:溶液PH值的计算
10-13 (1)1∶10 (2)10∶1 (3)1∶9
略
将物质的量均为3.00mol物质A、B混合于5L溶 器中,发生如下反应 3A+B![]() 2C,在反应过程中C的物质的量分数随温度变化
2C,在反应过程中C的物质的量分数随温度变化
如图所示:
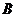
(1) T0对应的反应速率V正和V逆的关系是_____(用
含“>”“<”“=”表示,下同);
(2) 此反应的正反应为______热反应;
(3) X、Y两点A物质正反应速率的大小关系是______________;
(4) 温度T<T0时,C%逐渐增大的原因是________________________;
(5) 若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为_______;若Y点时所耗时间为2min,则B物质的反应速率为__________。
知识点:化学反应速率
(1)V正=V逆 (2)放热反应;
(3)Y>X;
(4)反应未达到平衡,反应仍在向正反应方向进行,故C%的逐渐增大。
(5)1.8mol;0.06mol/L·min
略
现有一包含有杂质(杂质不能与酸反应)的氢氧化钠固体,为测定其纯度,取m g固体溶于水,配成100 mL溶液,进行如下实验:
a.取25.0 mL所配溶液于锥形瓶中,并滴加2 ~ 3滴酚酞试液
b.用c mol·L-1标准盐酸润洗滴定管2 ~ 3次
c.把盛有标准盐酸的滴定管固定好,调节滴定管的尖嘴使之充满溶液
d.取标准盐酸并注入滴定管中至“0”刻度以上2 ~ 3mL处
e.调节液面到“0”或“0”刻度以下,记下读数
f.把锥形瓶放在滴定管的下方,用标准盐酸滴定至终点并记下滴定管的计数
请回答下列问题
(1) 在滴定过程中,目光应注视 ,判断滴定终点的标准是 。
(2) 正确的是操作顺序是:b→d→ →f。(填字母)
(3) 若滴定前后两次读数分别为a和b,则实验所配得NaOH溶液的物质的量浓度为
,NaOH的纯度为 。
(4) 若读取读数a时仰视,读取读数b时俯视,则所测氢氧化钠的纯度
(填“偏大”、“偏小”或“不变”)
知识点:综合性实验
(1) 锥形瓶中溶液颜色的变化;锥形瓶中的溶液颜色由红色变成无色,且30s内颜色不变
(2) c→e→a
(3) ![]() mol·L-1;
mol·L-1; ![]() %
%
(4) 偏小
略
某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3-、SO42-、Cl-,长期烧煮上述自来水会在锅炉内形成水垢.锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢.已知部分物质20℃时的溶解度数据有:
物质
Mg(OH)2
CaCO3
MgCO3
Ca(OH)2
CaSO4
MgSO4
溶解度
(g/100gH2O)
9.0×10-4
1.5×10-3
1.0×10-2
1.7×10-1
2.1×10-1
26.7
(1) 请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:___________________.
(2) 锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶
于盐酸的物质Y而除去.试剂X是________(填序号).
A.食醋 B.氯化钡
C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)______________________________
__________________________.
(3) 除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)_____________.
(4) 水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应.现取含Ca2+浓度为0.40 g/L的自来水样10 mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00 mL,则该自来水样中Mg2+的物质的量浓度是____________________(写出计算过程)。
知识点:物质的分离、除杂和提纯
(1)Mg(HCO3)2=====△MgCO3↓+H2O+CO2↑,
MgCO3+H2O=====△Mg(OH)2+CO2↑
(2) C 碳酸钙的溶解度小于硫酸钙的溶解度
(3)CaCO3、MgCO3等
略