下列物质分离方法错误的是
A.用过滤的方法除去食盐水中的泥沙 B.用四氯化碳萃取碘水中的碘
C.用蒸馏的方法将自来水制成蒸馏水 D.用分液的方法分离硫酸和水
知识点:物质的分离、除杂和提纯
D
本题主要考查物质的分离与提纯。硫酸与水互溶,不能用分液的方法分离,故D错。答案选D。
下列分类正确的是
A.Na2O、Na2O2、Al2O3、CuO都是碱性氧化物
B.纯碱、烧碱均属碱类
C.NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱
D.HCl、CH3COOH、HNO3都是强酸
知识点:物质的分类
C
本题主要考查物质的分类。Na2O2属于过氧化物,Al2O3属于两性氧化物,故A错;纯碱是碳酸钠,碳酸钠属于盐,故B错;CH3COOH是弱酸,故D错。答案选C。
科学的实验方法为我们探索物质世界提供了一把金钥匙。下列实验方法正确的是
A.配制一定物质的量浓度的溶液实验中,定容时,俯视观察刻度线,会引起配制溶液的浓度偏高
B.分液漏斗中上层和下层液体均可以从下口流出
C.冷凝管使用时冷水既可以从上口进也可以从下口进
D.不能用丁达尔效应鉴别Fe(OH)3胶体和CuSO4溶液
知识点:仪器和基本操作
A
本题主要考查化学实验基本操作。分液漏斗中上层液体从上口倒出,故B错;冷凝管使用时冷水下进上出,故C错;胶体能发生丁达尔效应而溶液不能,因此能用丁达尔效应鉴别胶体和溶液,故D错。答案选A。
实验室里需480mL1.0mol/LNaOH溶液,若用固体NaOH配制,则应选择的容量瓶规格为
A.480mL B.1000mL C.100mL D.500mL
知识点:仪器和基本操作
D
本题主要考查配制一定物质的量浓度的溶液。容量瓶选择原则是选用等于或大于但最接近所需体积的有这个规格的容量瓶,因此配制480mL应选用500mL容量瓶。答案选D。
下列叙述中,一定正确的是
A.某元素从化合态变为游离态时,该元素一定被还原
B.含金属元素的离子一定是阳离子
C.金属单质只有还原性,金属阳离子不一定只有氧化性
D.不同的气体,若体积不同,则它们所含的分子数一定不同
知识点:氧化还原反应
C
本题主要考查氧化还原反应。非金属元素处于负价变为游离态0价时,化合价升高被氧化,故A错;离子含有金属元素,故B错;根据公式pV=nRT可知若气体体积不同,当气体所处的状态不同时,气体的物质的量可能相同,分子数可能相同,故D错。答案选C。
下列说法错误的是
A.钠在空气中燃烧所得产物为Na2O2
B.镁因在空气中形成了一层致密的氧化膜,保护了里面的镁,故镁不需要进行特殊保护
C.铝制品在生活中非常普遍,这是因为铝不活泼
D.铁在潮湿的空气中因为生成的氧化膜很疏松不能保护内层金属,故铁制品往往需涂保护层
知识点:镁铝及其化合物
C
本题主要考查金属单质的化学性质。铝是活泼金属,铝易与空气中的氧气反应,在表面形成一层致密的氧化膜阻碍反应的继续进行,故C错。答案选C。
下列实验设计及其对应的离子方程式均正确的是
A.醋酸溶液除去水垢中的CaCO3:CaCO3+2H+ Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B.向稀盐酸溶液中加入铁粉:2Fe+6H+ 2Fe3++3H2↑
2Fe3++3H2↑
C.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ Cu2++ 2Fe2+
Cu2++ 2Fe2+
D.向AlCl3溶液中加入过量的氨水:Al3++ 4NH3·H2O + 4+ 2H2O
+ 4+ 2H2O
知识点:离子方程式
C
本题主要考查离子方程式的书写。醋酸属于弱酸,不能拆写,故A错;稀盐酸与铁粉反应生成Fe2+,故B错;氢氧化铝不溶于弱碱一水合氨,因此不能生成,故D错。答案选C。
在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是
A.Na+、Ag+、、Cl-
B.K+、Ba2+、、Cl-
C.Na+、K+、、Cl-
D.Na+、K+、Cl-、
知识点:离子共存
C
本题主要考查离子共存。溶液中Ag+和Cl-、反应产生沉淀,故A错;溶液中Ba2+和反应产生沉淀,故B错;溶液中能够共存,但加入硫酸没有气体产生,故D错。答案选C。
NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.5 mol Al与足量盐酸反应转移电子数为1NA
B.500mL 1mol/LNa2CO3溶液中,含有Na+离子数目为NA
C.常温常压下,11.2LO2(g)中含有O2分子数目为0.5NA
D.标准状况下,11.2 L H2O所含的分子数为0.5NA
知识点:物质的量的计算
B
本题主要考查阿伏伽德罗常数。1molAl与盐酸反应生成1mol Al3+,转移3mol电子,因此0.5 mol Al与足量盐酸反应转移电子数为1.5NA,故A错;常温下气体摩尔体积不等于22.4L/mol,计算出11.2LO2(g)中含有O2分子数目不等于0.5NA,故C错;标准状况下,11.2 L H2O为液态,不能用气体摩尔体积进行计算,故D错。答案选B。
下列物质既能跟盐酸反应,又能跟NaOH溶液反应的是
①Al ②Al2O3 ③Al(OH)3 ④Na2CO3溶液 ⑤Ca(HCO3)2溶液 ⑥KHSO4溶液
A.①②③⑥ B.①②③④ C.①②③⑤ D.①②③④⑤
知识点:镁铝及其化合物
C
本题主要考查元素化合物的性质。碳酸钠只能和盐酸反应、KHSO4只能和NaOH溶液反应,因此不能选④⑥,故C正确。答案选C。
为除去括号内的杂质,所选用的试剂或方法不正确的是
A.Na2CO3溶液(Na2SO4):加入适量的Ba(OH)2溶液,过滤
B.NaHCO3溶液(Na2CO3):应通入过量的CO2气体
C.Na2O2粉末(Na2O):将混合物在空气中加热
D.Na2CO3溶液(NaHCO3):选用适量NaOH溶液
知识点:物质的分离、除杂和提纯
A
本题主要考查物质的分离提纯。加入适量的Ba(OH)2溶液除去Na2CO3溶液中Na2SO4时,碳酸钠也与Ba(OH)2反应产生沉淀,故A错。答案选A。
已知在相同条件下,下列几种微粒的还原性强弱顺序为Cl-<Br-<Fe2+<I-<SO2,由此判断下列反应不能发生的是
A.2Fe3++SO2+2H2O +4H++2Fe2+
+4H++2Fe2+
B.2Br-++4H+ SO2+Br2+2H2O
SO2+Br2+2H2O
C.2Fe2++2Br-+2Cl2 2Fe3++Br2+4Cl-
2Fe3++Br2+4Cl-
D.2Fe3++2I- 2Fe2++I2
2Fe2++I2
知识点:氧化还原反应
B
本题主要考查氧化性与还原性的比较。若选项B能发生反应,根据还原性还原剂大于还原产物可知:Br->SO2,不符合题干所给还原性强弱顺序,故选项B中反应不能发生。答案选B。
向含有0.6molFeCl2的溶液中加入含0.1mol的酸性溶液,使溶液中Fe2+恰好全部被氧化为Fe3+,并使还原为Xn+,则n值为
A.2 B.3 C.4 D.6
知识点:氧化还原反应
B
本题主要考查氧化还原反应计算。根据得失电子数目守恒,0.6molFe2+失去0.6mol电子生成Fe3+,则0.1mol得到0.6mol电子,则Cr元素化合价从+6价变成+3价,故B正确。答案选B。
将钠、镁、铝各0.3 mol分别投入足量的盐酸中,同温同压下产生的气体体积比是
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
知识点:化学式的计算
A
本题考查了氧化还原反应的计算。由金属与酸反应的实质可知,盐酸足量,金属完全反应,金属失去的电子数等于H得到的电子数, Na失去的电子数为0.3mol, Mg失去的电子数为0.3mol×2=0.6mol, Al失去的电子数为0.3mol×3=0.9mol,则同温同压下产生气体的体积比0.3mol:0.6mol:0.9mol=1:2:3,故该题选A。
有两份质量分数分别为ω1和ω2的硫酸溶液,其物质的量浓度分别为c1和c2且c1=2c2(硫酸的密度大于水),下列说法正确的是
A.ω2<ω1<2ω2 B.ω1>2ω2
C.ω2>ω1>2ω2 D.ω1=2ω2
知识点:溶液浓度的计算
A
本题主要考查物质的量浓度的相关计算。硫酸浓度越大,质量分数越大,.因此ω2<ω1,因此根据公式c=可推出:ω1=,ω2=,因为硫酸的密度比水大,因此溶液浓度越大,密度越大,即>,又因为c1=2c2,因此ω1<2ω2,综上所述,质量分数的关系是ω2<ω1<2ω2。答案选A 。
镁、铝混合粉末10.2g溶于500mL 4mol/L盐酸中,若再加入1000mL的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为
A.0.5mol/L B.1mol/L C.1.5mol/L D.2mol/L
知识点:溶液浓度的计算
D
本题主要考查元素及其化合物的性质。由题意可知,镁铝混合粉末与盐酸反应生成金属氯化物,金属氯化物与氢氧化钠溶液反应产生沉淀,当沉淀达到最大值时,溶液为NaCl溶液,根据Na+与Cl-物质的量相等,可知n(NaOH)=n(HCl)= 500mL ×4mol/L=2mol,c(NaOH)= 2mol/L。
掌握电解质和非电解质的概念,能熟练判断一种物质是不是电解质是认识电解质的性质、研究离子反应的前提。以下有10种物质:①铜②稀硫酸③氯化氢④氨气⑤空气⑥二氧化碳⑦熔融NaHSO4⑧氯化钠⑨碳酸钙⑩氯气
(1)上述物质属于电解质的是 ;
(2)写出NaHSO4在水溶液中的电离方程式: ;它属于 (“酸”“碱”“盐”)。
(3)向明矾KAl(SO4)2•12H2O的溶液中加入Ba(OH)2溶液至沉淀质量最大,发生反应的离子方程式为:
知识点:离子方程式
(1)③⑦⑧⑨
(2)NaHSO4 Na++H++ 盐
Na++H++ 盐
(3)Al3++2+2Ba2++4OH− 2BaSO4↓++2H2O
2BaSO4↓++2H2O
解析:本题主要考查离子反应。(1)根据电解质的定义,属于电解质的是③⑦⑧⑨;(2) NaHSO4在水溶液中的电离方程式:NaHSO4 Na++H++,它属于盐。(3)假设KAl(SO4)2•12H2O为1mol,产生2mol硫酸钡时,沉淀质量最大,因此离子方程式为:Al3++2+2Ba2++4OH−
Na++H++,它属于盐。(3)假设KAl(SO4)2•12H2O为1mol,产生2mol硫酸钡时,沉淀质量最大,因此离子方程式为:Al3++2+2Ba2++4OH− 2BaSO4↓++2H2O
2BaSO4↓++2H2O
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是__________。
(2)该反应中,发生还原反应的过程是_________→___________。
(3)写出该反应的化学方程式,并用单线桥或双线桥标出电子转移的方向和数目________________________________________________________
(4)若反应转移了0.3mol电子,则产生的气体在标准状况下体积为 _______。
知识点:氧化还原反应
(1)H2O2 (2) H2CrO4 Cr(OH)3
(3)2H2CrO4+3H2O2 2Cr(OH)3+3O2↑+2H2O
2Cr(OH)3+3O2↑+2H2O
(4)3.36L
解析:本题主要考查氧化还原反应。(1)由该反应中的转化关系H2O2→O2,可知氧元素化合价升高,H2O2作还原剂。(2)根据电子得失数目守恒,该反应中,发生还原反应的过程是H2CrO4→ Cr(OH)3。(3) 由转化关系,运用升降法配平可得反应的化学方程式: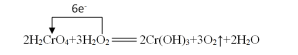 。(4)根据反应方程式可得下列算式:
。(4)根据反应方程式可得下列算式: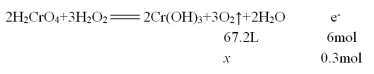 ,解算式得x=3.36L。
,解算式得x=3.36L。
有一无色溶液,其中可能含有Fe3+、Cu2+、K+、Al3+、Mg2+、、Cl−等离子中的几种,为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如下:
①蘸取该溶液做焰色反应实验,透过蓝色钴玻璃,观察到火焰呈紫色。
②向该溶液中加入Ba(NO3)2溶液,观察到有白色沉淀产生。
③向该溶液中逐滴加入过量NaOH溶液,观察到有白色沉淀产生,生成
白色沉淀的量与加入NaOH的量有如图所示的相互关系。据此可知:

(1)在原溶液中一定存在的离子有_______________;一定不存在的离子有_______________;不能确定是否存在的离子有____________;
(2)写出图2中沉淀的量减少时发生反应的离子方程式_____________________________________________________________。
(3)为满足该溶液中一定存在的离子的要求,一般可溶解两种常见物质为(写化学式)______和________。
知识点:离子共存
(1)Al3+、Mg2+、K+、; Fe3+、Cu2+; Cl-
(2)Al(OH)3+OH— +2H2O
+2H2O
(3)KAl(SO4)2(或KAl(SO4)2•12H2O);MgSO4
解析:本题主要考查离子检验。根据题意,无色溶液中一定不存在Fe3+和Cu2+,根据实验①可知一定存在K+,根据实验②可知一定存在,根据实验③加入过量NaOH溶液,产生白色沉淀又部分溶解,说明一定存在Al3+和Mg2+。综上所述(1)在原溶液中一定存在的离子有Al3+、Mg2+、K+、;一定不存在的离子有Fe3+、Cu2+;不能确定是否存在的离子有Cl-;(2)图2中沉淀的量减少为氢氧化铝溶解:Al(OH)3+OH— +2H2O。(3)满足条件的溶解物质可以是KAl(SO4)2(或KAl(SO4)2•12H2O)和MgSO4。
+2H2O。(3)满足条件的溶解物质可以是KAl(SO4)2(或KAl(SO4)2•12H2O)和MgSO4。
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色。请填写下列空白:

(1)写出化学式:
A____________、B____________、C____________、D____________。
(2)写出物质B的用途_______________________________________________。
(3)写出A→C反应的离子方程式_____________________________________;
B→D反应的化学方程式__________________________________。
(4)向饱和Na2CO3溶液中通入足量CO2,现象是____________________________。
知识点:钠和碱金属
(1)Na;Na2O2;NaOH;Na2CO3;
(2)供氧剂;
(3)2Na+2H2O 2Na++2OH−+H2↑;2Na2O2+2CO2
2Na++2OH−+H2↑;2Na2O2+2CO2 2Na2CO3+O2.
2Na2CO3+O2.
(4)有白色晶体析出
解析:本题主要考查钠及其化合物的性质。(1)根据流程图可知及焰色反应呈黄色可知A为Na,B为 Na2O2,C为NaOH ,D 为Na2CO3。(2) Na2O2因与二氧化碳和水反应生成氧气,故可作高空作业和深水作业的供氧剂。(3)钠与水反应的离子方程式:2Na+2H2O 2Na++2OH−+H2↑,过氧化钠与水反应的化学方程式:2Na2O2+2CO2
2Na++2OH−+H2↑,过氧化钠与水反应的化学方程式:2Na2O2+2CO2 2Na2CO3+O2。(4) 向饱和Na2CO3溶液中通入足量CO2生成碳酸氢钠,碳酸氢钠溶解度小从饱和溶液中析出,因此现象为有白色晶体析出。
2Na2CO3+O2。(4) 向饱和Na2CO3溶液中通入足量CO2生成碳酸氢钠,碳酸氢钠溶解度小从饱和溶液中析出,因此现象为有白色晶体析出。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)_______________;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其加热时都能发生的反应的化学方程式为_____________________________________。
(3)有同学认为,除上述试验方法外,向两种固体配成的溶液中加入澄清石灰水也可以区分它们,这种说法是__________(填“正确”或“错误”)的。其中向NaHCO3溶液中加入足量澄清石灰水,发生反应的离子方程式为:___________________________________________________________。
(4)另有两瓶溶液,已知分别是K2CO3溶液和NaHCO3溶液,请你写出鉴别方法。
____________________________________________________________________。
知识点:综合性实验
(1)Ⅱ
(2)2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(3)错误
HCO3-+Ca2++OH- CaCO3↓+ H2O
CaCO3↓+ H2O
(4)焰色反应,透过蓝色钴玻璃能看到紫色焰色的是K2CO3,否则是NaHCO3
(加入BaCl2(或CaCl2)溶液,产生白色沉淀的是K2CO3,否则是NaHCO3)
(滴入稀盐酸,立即产生气泡或产生气泡较多的是NaHCO3,否则是K2CO3)
解析:本题主要考查化学实验方案设计与评价。(1)碳酸钠和碳酸氢钠都能与盐酸反应产生二氧化碳使澄清的石灰水变浑浊,因此图Ⅰ不能达到实验目的;称取等质量的固体放入过量的盐酸中,根据气球膨胀体积不同可以鉴别产生气体多的是碳酸氢钠,因此能达到目的的是Ⅱ。(2)加热时碳酸氢钠分解,化学方程式为:2NaHCO3 Na2CO3+H2O+CO2↑。(3)向两种固体配成的溶液中加入澄清石灰水都能产生白色沉淀,因此该方法是错误的,其中向NaHCO3溶液中加入足量澄清石灰水,发生反应的离子方程式为:HCO3-+Ca2++OH-
Na2CO3+H2O+CO2↑。(3)向两种固体配成的溶液中加入澄清石灰水都能产生白色沉淀,因此该方法是错误的,其中向NaHCO3溶液中加入足量澄清石灰水,发生反应的离子方程式为:HCO3-+Ca2++OH- CaCO3↓+ H2O。(4)鉴别K2CO3溶液和NaHCO3溶液的方法有多种:焰色反应,透过蓝色钴玻璃能看到紫色焰色的是K2CO3,否则是NaHCO3(加入BaCl2(或CaCl2)溶液,产生白色沉淀的是K2CO3,否则是NaHCO3)(或滴入稀盐酸,立即产生气泡或产生气泡较多的是NaHCO3,否则是K2CO3)。
CaCO3↓+ H2O。(4)鉴别K2CO3溶液和NaHCO3溶液的方法有多种:焰色反应,透过蓝色钴玻璃能看到紫色焰色的是K2CO3,否则是NaHCO3(加入BaCl2(或CaCl2)溶液,产生白色沉淀的是K2CO3,否则是NaHCO3)(或滴入稀盐酸,立即产生气泡或产生气泡较多的是NaHCO3,否则是K2CO3)。
将2.4克镁投入500 mL 1 mol/L盐酸中,试计算(请按照解题步骤写出详细解答过程):
(1)标准状况下,生成H2的体积。
(2)若反应完成后,溶液体积仍为500 mL,此时溶液中的Mg2+和H+的物质的量浓度分别是多少?
知识点:溶液浓度的计算
(1)2.24L。
(2)c(Mg2+)=0.1 mol /0.5L=0.2mol/L c(H+)=(0.5-0.2) mol /0.5L=0.6mol/L
本题主要考查与化学反应有关的计算。
(1)
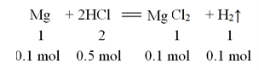
由Mg和HCl物质的的量和化学计量数的比例关系可知:反应中盐酸过量,应以Mg为标准计算生成H2的体积,故有V(H2)=0.1 mol×22.4L/ mol =2.24L。(2)因溶液中Mg2+为0.1 mol ,则溶液中c(Mg2+)=0.1 mol /0.5L=0.2mol/L,溶液中过量H+的浓度c(H+)=(0.5-0.2) mol /0.5L=0.6mol/L。
【备注】Mg + 2HCl ZnCl2 + H2↑
ZnCl2 + H2↑
1 2 1 1
0.1 mol 0.5 mol 0.1 mol 0.1 mol