化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料;⑥2M+N=2P+2Q ,2P+M= Q
(M、N为原料,Q为期望产品),其中符合“化学反应的绿色化”的要求的是
A. ①③④⑤ B. ②③⑤⑥ C. ①②③④ D. ②④⑤⑥
知识点:化学与社会的相互关系
B
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO3-
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
知识点:离子共存
A
下列有关物质性质的描述和该性质的应用均正确的是( )
A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
知识点:元素及其化合物的综合运用
C
下列有关实验装置进行的相应实验,能达到实验目的的是




图1 图2 图3 图4
A.用图1装置制取并收集干燥纯净的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
知识点:综合性实验
C
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.78gNa2O2固体中含有的阴离子数为NA
B.标准状况下,2.24L氖气所含原子数为0.2NA
C.1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA
D.标准状况下,2.24L己烷含有分子的数目为0.1NA
知识点:物质的量的计算
A
下列表示对应化学反应的离子方程式正确的是
A.工业电解饱和食盐水:2Cl-+ H2O = Cl2↑+ H2↑+ OH-
B.碳酸钠的水解:CO32-+ 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
C.硫酸铝溶液中滴加过量浓氨水:Al3++4 NH3·H2O===AlO2-+4NH4++2H2O
D.用过氧化氢从酸化海带灰浸出液中提取碘:2I-+ H2O2 +2H+ = I2 +2H2O
知识点:离子方程式
D
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al ② NH3
Al ② NH3 NO
NO HNO3
HNO3
③NaCl(饱和) NaHCO3
NaHCO3 Na2CO3 ④FeS2
Na2CO3 ④FeS2 SO3
SO3 H2SO4
H2SO4
A.②③ B.①④ C.②④ D.③④
知识点:元素及其化合物的综合运用
A
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的过程正确的有:
①蛋白质的变性 ②蛋白质的盐析 ③胶体的聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A.①②③④ B.①③④⑥ C.②③④⑤ D.②③⑤⑥
知识点:氧化还原反应
B
下列溶液中的Cl-浓度与50 mL 1 mol·L-1 MgCl2溶液中的Cl-浓 度相等的是( )
度相等的是( )
A.150 mL 1 mol·L-1 NaCl溶液
B.75 mL 2 mol·L-1 CaCl2溶液
C.150 mL 2 mol·L-1 KCl溶液
D.75 mL 1 mol·L-1 AlCl3溶液
知识点:溶液浓度的计算
C
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH4+)> c(SO42-)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c (CH3COO-) > c (Na+) > c (H+)> c (OH-)
知识点:离子浓度比较
D
下列物质分类的正确组合是
分类
组合
纯净物
酸
盐
碱性氧化物
酸性氧化物
A
碱石灰
乙二酸
纯碱
氧化铝
二氧化碳
B
盐酸
石炭酸
小苏打
氧化镁
二氧化氮
C
H2O2
硬脂酸
苏打
过氧化钠
二氧化硫
D
五水硫酸铜
油酸
碱式碳酸铜
氧化钠
三氧化硫
知识点:物质的分类
D
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2===LiNH2+LiH,下列有关说法正确的是( )
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H-的离子半径相等
D.此法储氢和钢瓶储氢的原理相同
知识点:氧化还原反应
B
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH溶液的体积为1L),则下列判断不正确的是( )

A. NaOH的浓度为0.6mol/L B. 在a点处溶液中的溶质为NaCl
C.在b点处溶液中的溶质只有NaAlO2 D. 图中线段oa:ab=5:1
知识点:镁铝及其化合物
C
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。写出其中D与水反应生成的酸名称 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性 。写出②反应的化学方程式 。
。写出②反应的化学方程式 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式 。
知识点:无机框图推断
(1) 硫酸、
(2) 4NH3+5O2==4NO+6H2O (条件:催化剂 加热)
(3)AlO2- +2H2O+CO2==Al(OH)3 ↓+ HCO3- (4) Si+2NaOH+2H2O=Na2SiO3+2H2↑
(5) Fe+2Fe3+=3Fe2+
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。

请回答:(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如图7所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。

(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式 , 请选出你认为的最佳途径并说明选择的理由 。
知识点:元素及其化合物的综合运用
(1)2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)稀硫酸或H2SO4(2分) 过滤
(3)在装置a、b之间增加一个盛有饱和NaHCO3溶液的洗气瓶(合理答案即给分))
(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O 途径②最佳,理由是原料利用率高,环境污染小
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
 火法炼铜:Cu2S+O2 2Cu+SO2
火法炼铜:Cu2S+O2 2Cu+SO2
 湿法炼铜:CuSO4+Fe FeSO4+Cu
湿法炼铜:CuSO4+Fe FeSO4+Cu
上述两种方法中,铜元素均被_____ _____ (填“氧化”还是“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:

①步骤1中反应的离子方程式是______ _________。
②步骤2所加的氧化剂最适宜的是____________ ________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为____ ______
[Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是____ ______(写出一种即可)。
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是__________ _____________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。并写出电极反应式

知识点:化学
(1)还原(2) ①2Fe3++Cu=2Fe2++Cu2+②B
③4×10-11 mol/L CuO[或Cu(OH)2] ④CuCl2在溶液中可以发生水解反应:CuCl2+2H2O
④CuCl2在溶液中可以发生水解反应:CuCl2+2H2O Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
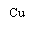
 (3)如右图
(3)如右图 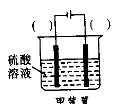 阳极:Cu-2e-=Cu2+ 阴极:2H++2e-=H2
阳极:Cu-2e-=Cu2+ 阴极:2H++2e-=H2
(1)某短周期主族元素的原子M层上有一个半充满的亚层,这种原子的质子数是 _____ ______,写出它的外围电子排布图________ ___。
(2)VIA族的.硒(Se).在化合物中常表现出多种氧化态, H2SeO4比H2SeO3酸性_ __( 填强或弱),H2Se的酸性比H2S____ ______(填“强”或“弱”)。
(3)固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中正确的是 ( )
A.NH5中既有离子键又有共价键
B.NH5的熔、沸点高于NH3
C.NH5固体投入少量水中,可产生两种气体
D.0.1 mol NH5中含有5 mol N—H键
(4)用氢键表示式写出HF溶液中存在的所有氢键。 .
知识点:元素周期律与元素周期表
(1)11号或15号磷 3s1或3s2 3p3
(2)H2SeO4比H2SeO3强,H2Se的酸性比H2S强
(3)ABC (4)F-H..O F-H..F O-H..F O-H..O
脱水偶联反应是一种新型的直接烷基化反应,例如:

(1)化合物Ⅰ中含有的官能团的名称为 ,1mol该物质完全水解最少需要消耗 mol NaOH。
(2)化合物Ⅱ可使 溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11C1)可与NaOH水溶液共热生成化合物Ⅱ,相应的反应类型为__ ____.
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为为1:1:1:2,Ⅳ的结构简式为____ ___.
(4)化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ.Ⅵ的结构简式为___ ___.检验Ⅵ中所含官能团,按使用的先后顺序写出所用试剂————————
(5)一定条件下,
也可以发生类似反应①的反应,有机产物的结构简式为 .
知识点:有机化学知识综合应用
(1) 羰基和酯基 1
(2) 溴水或酸性高锰酸钾 水解反应(取代反应)
(3)Ⅳ的结构简式为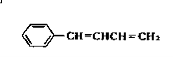
(4)Ⅵ的结构简式为:OHC-CH=CH-CHO
检验Ⅵ中的碳碳双键和醛基时,用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键。在这里不能先检验碳碳双键。也可以用酸性高猛酸钾检验碳碳双键。
(5) 